পরমাণু খুবই ক্ষুদ্র কণা । সাধারনত এরা দৈর্ঘ্যে ১০০ পিকোমিটার (১ মিটারের ১০,০০০,০০০,০০০ ভাগের ১ ভাগ)। তাই এর গঠন সম্পর্কে ধারণা পাওয়া সহজ নয় । ইলেক্ট্রন ,প্রোটন আর নিউট্রন দিয়ে তৈরি মেীলিক পদার্থের ক্ষুদ্রতম একক হচ্ছে পরমাণু । পরমাণুর মাঝখানে আছে প্রোটন আর নিউট্রন দিয়ে তৈরি খুবই ছোট একটি নিউক্লিয়াস এবং সেটিকে ঘিরে ঘুরছে ইলেক্ট্রন। কত সহজে এক লাইনে বলে ফেললাম পরমাণুর গঠন সম্পর্কে ! বিষয়টি মোটে ও এত সহজ ছিল না । আপনি চিন্তা ও করতে পারবেন না কত হাজার বছর ধরে কত শত বিজ্ঞানী কত গবেষণা এবং পরীক্ষা নিরীক্ষার মাধমে বের করতে পেরেছিলেন এই সত্যটি । আজকের টিউটরিয়ালে আমরা পরমাণুর গঠন , এর বৈশিষ্ট্য , মোলিক কণিকাসমূহ , অণু ও পরমাণুর পার্থক্য এবং এদের আবিষ্কার ইত্যাদি নিয়ে আলোচনা করব ।
পরমাণুর ধারণার বিকাশ ও গঠন
আমরা জানি , পদার্থ ক্ষুদ্র কণা দ্বারা গঠিত। এ ক্ষুদ্র কণা দুই রকমের- অণু ও পরমাণু। পরমাণু ক্ষুদ্রতম কণা। একের অধিক পরমাণু পরস্পরের সাথে যুক্ত হয়ে অণু গঠন করে। ক্ষুদ্রতম কণার বিষয়ে বিভিন্ন সময়ে বিজ্ঞানী ও দার্শনিকগণ নানা রকম মতবাদ ব্যক্ত করেছেন।
ভারতীয় দার্শনিক কণাদ খ্রীস্টের জন্মের ৬০০ বছর আগে পরমাণুর ধারণা দেন । তিনি বলেন সকল পদার্থই ক্ষুদ্র এবং অবিভাজ্য কণিকা দ্বারা তৈরী। পরমাণু তত্ত্ব গ্রিক দার্শনিকেরা দেন পরীক্ষা ও পর্যবেক্ষণ করে ব্যবহার করে নয়, বরং দার্শনিক দৃষ্টিভঙ্গি থেকে পদার্থের তত্ত্ব নির্মাণের চেষ্টা করেন। এ ধারার প্রথম দার্শনিক ছিলেন মিলেতুসের লেউকিপ্পুস (খ্রিস্টপূর্ব ৫ম শতাব্দী)। তার বিখ্যাত শিষ্য আবদেরার
গ্রীক দার্শনিক ডেমোক্রিটাস খ্রিস্টপূর্ব ৪০০ অব্দে সর্বপ্রথম পদার্থের ক্ষুদ্রতম কণা নিয়ে মতবাদ পোষণ করেন। তার মতে সকল পদার্থই ক্ষুদ্ৰ ক্ষুদ্ৰ অবিভাজ্য (যা আর ভাঙ্গা যায় না) কণা দ্বারা গঠিত।
তিনি এই ক্ষুদ্রতম কণার নাম দেন পরমাণু বা এটম। এটম কথাটি তিনি নিয়েছিলেন গ্রীক শব্দ এটোমোস (Atomos) থেকে যার অর্থ হলো অবিভাজ্য। তার সমসাময়িক সময়ের আরও দুজন দার্শনিক প্লেটো (Plato)
এবং অ্যারিস্টটল ( Aristotle) তার মতবাদের সাথে দ্বিমত পোষণ করেন। অ্যারিস্টটলের মতে পদার্থসমূহ নিরবচ্ছিন্ন (Continuous), একে যতই ভাঙ্গা হোক না কেন, পদার্থের কণাগুলো ক্ষুদ্র হতে ক্ষুদ্রতর হতে থাকবে।
১৮০৩ সালে ইংরেজ বিজ্ঞানী জন ডাল্টন (John Dalton) পরীক্ষালব্ধ তথ্যের উপর ভিত্তি করে পদার্থের ক্ষুদ্রতম কণা সম্পর্কে বলেন-
পরমাণু হলো মৌলিক পদার্থের ক্ষুদ্রতম কণা এবং একে আর ভাঙ্গা যায় না। ডাল্টনের এ মতবাদ সকলে গ্রহণ করে। ফলে অ্যারিস্টটলের মতবাদটি পরিত্যক্ত হয়।
আসলে পরমাণু অবিভাজ্য নয় বা ক্ষুদ্রতম কণিকাও নয়। পরমাণু বিভাজ্য। এরা ইলেকট্রন, প্রোটন ও নিউট্রন দ্বারা গঠিত।
ডাল্টনের পরমাণুবাদের এই সীমাবদ্ধতা দূর করার জন্য পরবর্তীতে আরও অনেকে পরমাণু মডেলের প্রস্তাব করেন। এদের মধ্যে রাদারফোর্ড ও বোরের পরমাণু মডেল গ্রহণযোগ্যতা পায়
একসময় বিজ্ঞানী রাদারফোর্ড ও তাঁর সহকর্মীরা একটি পরীক্ষা করেন যা পরমাণুর গঠন সম্পর্কে ভালো ধারণা দেয়। পরীক্ষালব্ধ ফল থেকে রাদারফোর্ড বলেন যে, পরমাণুতে ধনাত্মক আধান ও ভর একটি ক্ষুদ্র জায়গায় আবদ্ধ।
তিনি এর নাম দেন নিউক্লিয়াস। তিনি আরও ব্যাখ্যা দেন যে, পরমাণুর বেশিরভাগ জায়গা ফাঁকা, আর ঋণাত্মক আধানযুক্ত কণার তেমন কোনো ভর নেই এবং তারা নিউক্লিয়াসকে কেন্দ্র করে ঘুরছে।
রাদারফোর্ডের মডেল সৌরজগতের মতো। কিন্তু রাদারফোর্ড নির্দিষ্ট কোনো কক্ষপথের কথা বলেননি। বিজ্ঞানী বোর পরবর্তীকালে ধারণা দেন যে, ঋণাত্মক আধানযুক্ত কণা কিছু নির্দিষ্ট কক্ষপথে ঘুরে।
উপরিউক্ত আলোচনা থেকে বলা যায় যে, পরমাণু অবিভাজ্য নয়। পরমাণু ইলেকট্রন, প্রোটন ও নিউট্রনের সমন্বয়ে গঠিত। পরমাণুর কেন্দ্রে রয়েছে নিউক্লিয়াস। নিউক্লিয়াসে ধনাত্মক আধানযুক্ত প্রোটন ও
আধান নিরপেক্ষ নিউট্রন রয়েছে। পরমাণুর ভরের প্রায় পুরোটাই নিউক্লিয়াসে থাকে। ঋণাত্মক আধানযুক্ত ইলেকট্রন নিউক্লিয়াসকে কেন্দ্র করে নির্দিষ্ট কক্ষপথে ঘুরে। ইলেকট্রন ও নিউক্লিয়াসের মধ্যবর্তী জায়গা ফাঁকা।
প্রকৃতপক্ষে পরমাণুর বেশিরভাগ জায়গা ফাঁকা
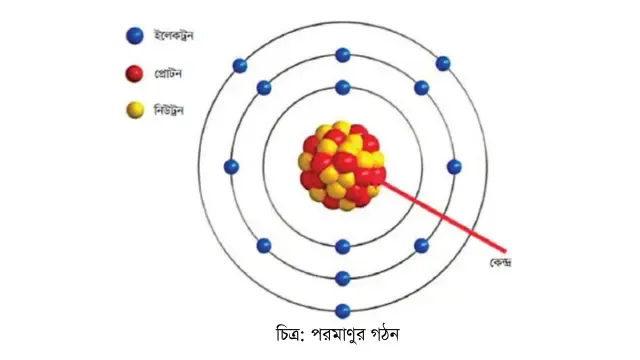
পরমাণুর গঠন
অণু :
অণু শব্দের অর্থ ক্ষুদ্র। যৌগিক বা মৌলিক পদার্থের ক্ষুদ্রতম কণা যা ঐ বস্তুর ধর্মাবলি অক্ষুণ্ণ রেখে স্বাধীনভাবে বিরাজ করতে পারে তাকে সে বস্তুর অণু বলে।
কোনো পদার্থের ধর্মই তার অণুর ধর্ম। যেমন— পানির অণু ( )। দুটি মৌলিক পদার্থ হাইড্রোজেন ও অক্সিজেনের সমন্বয়ে পানি গঠিত। অণু রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে না ।
১৮১১ সালে বিজ্ঞানী অ্যাভোগ্যাড্রো প্রথম অণুর ধারণা দেন।
পরমাণু : ‘পরম' শব্দের অর্থ অত্যন্ত আর ‘অণু' শব্দের অর্থ ক্ষুদ্র। পরমাণু শব্দের অর্থ 'অত্যন্ত ক্ষুদ্র'। মৌলিক পদার্থের যে ক্ষুদ্রতম কণা অবিভাজ্য অবস্থায় রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে এবং যার মধ্যে মৌলিক পদার্থটির সব ভৌত ও রাসায়নিক ধর্ম বর্তমান থাকে তাকে পরমাণু বলে। ' যেমন- অক্সিজেন মৌলিক পদার্থের ক্ষুদ্রতম অংশ অক্সিজেন পরমাণু (O)। পরমাণু বা এটম এর নাম দেন ডেমোক্রিটাস। এটম শব্দের অর্থ অখণ্ডনীয় যাকে আর ভাগ করা যায় না। ব্রিটিশ স্কুল শিক্ষক জন ডান্টন ১৮০৩ সালে এটম এর নতুন ধারণা দেন। একটি পরমাণু কণার ওজন আছে, আয়তন আছে। পরমাণুতে ইলেক্ট্রন, প্রোটন এবং নিউট্রন থাকে। এর মধ্যে প্রোটন ধনাত্মক চার্জযুক্ত, ইলেক্ট্রন ঋণাত্মক চার্জযুক্ত এবং নিউট্রন চার্জ নিরপেক্ষ । একটি পরমাণুতে স্বাভাবিক অবস্থায় প্রোটন এবং ইলেকট্রনের সংখ্যা সমান থাকে ফলে পরমাণুটি চার্জ নিরপেক্ষ হয়। ইলেকট্রন আদান প্রদানের ফলে পরমাণু চার্জপ্রাপ্ত হয়ে বিক্রিয়ায় অংশ নেয় ।
| পরমাণু | অণু |
|---|---|
| মৌলিক পদার্থের বৈশিষ্ট্য রক্ষাকারী ক্ষুদ্রতম কণা । | মৌলিক ও যৌগিক পদার্থের বৈশিষ্ট্য রক্ষাকারী ক্ষুদ্রতম কণা । |
| পরমাণু সরাসরি রাসায়নিক বিক্রিয়ায় অংশ গ্রহণ করে। | অণু সরাসরি রাসায়নিক বিক্রিয়ায় অংশ গ্রহণ করে না । |
| পরমাণু অণুর অংশ । | এক বা একাধিক পরমাণুর সমষ্টি হল অণু । |
| পরমাণু অণুর চেয়ে ছোট | অণু পরমাণু চেয়ে বড় |
তথ্যকণিকা :
সর্বপ্রথম পদার্থের ক্ষুদ্রতম অংশের Atom নামকরণ করেন : ডেমোক্রিটাস ।
বস্তুর ধর্ম ধারণ করে এরকম ক্ষুদ্রতম কণিকার নাম: অণু ।
মৌলিক গ্যাসের অণুতে সাধারণত পরমাণু: দুইটি ।
যে মৌলিক গ্যাসের অণু এক-পরমাণুক: নিষ্ক্রিয় গ্যাস।
যে মৌলের অণুতে দুইয়ের অধিক পরমাণু থাকে: ওজোন ( ), ফসফরাস ( ), সালফার ( ) ইত্যাদি।
20 এবং এর মধ্য পার্থক্য: 20 হল অক্সিজেনের দুটি বিচ্ছিন্ন পরমাণু এবং হল অক্সিজেনের একটি অণু যাতে রয়েছে বন্ধনে আবদ্ধ অক্সিজেনের দুটি পরমাণু ।
পারমাণবিক কণাগুলোর বৈশিষ্ট্য: ওজন আছে, আয়তন আছে।
পরমাণুর মৌলিক কণিকা
যে সকল সূক্ষ্ম কণিকা দ্বারা পরমাণু গঠিত তাদের মৌলিক কণিকা বলে। একটি পরমাণুতে তিনটি মৌলিক কণিকা থাকে। তিনটি মৌলিক কণিকা অতীব স্থায়ী।
মূলত মূল কণিকা দুই প্রকারঃ
[ক] স্থায়ী মূল কণিকা
[খ] অস্থায়ী মূল কণিকা ।
স্থায়ী মূল কণিকা: যেসব মূল কণিকা সব মৌলের পরমাণুতে থাকে, তাদের স্থায়ী মূল কণিকা বলে। স্থায়ী মূল কণিকা গুলো হচ্ছে ইলেকট্রন, প্রোটন ও নিউট্রন ।
অস্থায়ী মূল কণিকা: যেসব মূল কণিকা কোন কোন মৌলের পরমাণুতে খুব অল্প সময়ের জন্য অস্থায়ীভাবে থাকে, তাদের অস্থায়ী মূল কণিকা বলে। অস্থায়ী মূল কণিকা সৃষ্টির সাথে সাথে অন্য কণিকায় পরিণত হয়।
অস্থায়ী মূল কণিকার উদাহরণ: পাইওন, মিউওন, নিউট্রিনো, মেসন প্রভৃতি
ইলেকট্রন : পরমাণুর ঋণাত্মক আধানবিশিষ্ট কণিকা হল ইলেকট্রন। ইলেকট্রন হল অতি ক্ষুদ্র কণিকা। থমসন ১৮৯৭ সালে এটি আবিষ্কার করেন। পরমাণুর সর্বশেষ কক্ষপথের ইলেকট্রন বিন্যাস, ২, ৮, ১৮, ৩২, .... ঘর্ষণ, তাপ, রাসায়নিক ইত্যাদি প্রক্রিয়ায় পরমাণুর বহিঃস্থ কক্ষপথের ইলেকট্রন নির্গত হয়। ইলেকট্রনের সংকেত = , ভর = , চার্জ : Coulomb
প্রোটন : পরমাণুর ধনাত্মক আধানবিশিষ্ট কণিকা প্রোটন। এর ভর হাইড্রোজেনের ভরের প্রায় সমান। রাদারফোর্ড ১৯১৯ সালে এটি আবিষ্কার করেন। হাইড্রোজেন পরমাণুতে একটি প্রোটন ও একটি ইলেকট্রন রয়েছে। এটি সবচেয়ে হালকা মৌল। প্রোটনের সংকেত = , চার্জ = Coulomb , ভর =
নিউট্রন : পরমাণুর আধানহীন কণিকা হল নিউট্রন। ১৯৩২ সালে বিজ্ঞানী চ্যাডউইক এ কণিকা আবিষ্কার করেন। এর ভর প্রোটন অপেক্ষা সামান্য বেশি। হাইড্রোজেন পরমাণুতে নিউট্রন নেই। পরমাণুর ওজন প্রোটন ও নিউট্রনের ওজনের সমান। নিউট্রনের ভর =
নিউক্লিয়াস : পরমাণুর কেন্দ্র হল নিউক্লিয়াস। এতে প্রোটন ও নিউট্রন অবস্থান করে। সুতরাং পরমাণুর সকল ধনাত্মক আধান এবং প্রায় সম্পূর্ণ ভর নিউক্লিয়াসে কেন্দ্রীভূত। ইলেকট্রন নিউক্লিয়াসের বাইরে থাকে এবং তার চারদিকে পরিভ্রমণ করে। আমরা জানি পরমাণু অত্যন্ত ক্ষুদ্র। নিউক্লিয়াস পরমাণুর তুলনায় অনেক ক্ষুদ্র। একটি পরমাণুর ব্যাস এবং । নিউক্লিয়াসের ব্যাস প্রায় , এক লক্ষ ভাগের এক ভাগ।
তথ্য কণিকা :
ইলেকট্রন নিউক্লিয়াসের বাইরে থাকে এবং তা নিউক্লিয়াসকে কেন্দ্র করে চারিদিকে বিভিন্ন কক্ষপথে ঘুরতে থাকে।
মৌলিক কণিকাগুলোর চার্জ: ইলেকট্রন- ঋণাত্নক চার্জযুক্ত; প্রোটন- ধনাত্নক চার্জযুক্ত; নিউট্রন- চার্জবিহীন।
পরমাণু চার্জ নিরপেক্ষ হয়: পরমাণুতে ইলেকট্রন ও প্রোটনের সংখ্যা সমান ।
“নিউট্রন' নামের তাৎপর্য: আধানবিহীন (Neutral) হওয়ার কারণেই এই নামকরণ করা হয়।
ইলেকট্রনের প্রকৃত আধানঃ Coulomb
প্রোটনের প্রকৃত আধান : Coulomb .
ইলেকট্রনের আসল ভরঃ
প্রোটনের আসল ভরঃ
নিউট্রনের আসল ভরঃ .
যে মৌলিক কণিকার ভর সবচেয়ে কমঃ ইলেকট্রন ।
যে মৌলিক কণিকার ভর সবচেয়ে বেশি: নিউট্রন ।
যে মৌলের পরমাণুতে নিউট্রন নেই: হাইড্রোজেন।
ঘর্ষণ, তাপ, রাসায়নিক প্রভৃতি প্রক্রিয়ায় সহজেই পরমাণু থেকে যে মূল কণিকা নির্গত হয়: ইলেকট্রন।
স্থায়ী মূল কণিকার আবিষ্কারক : ইলেকট্রন আবিষ্কার করেন থমসন , প্রোটন আবিষ্কার করেন রাদারফোর্ড , নিউট্রন আবিষ্কার করেন চ্যাডউইক ।
নিউক্লিয়াসের ধনাত্মক আধান বৃদ্ধি পায় কখন :
যে কোনো পর্যায়ে যতই ডানদিকে যাওয়া যায় অর্থাৎ পারমাণবিক সংখ্যা যতই বাড়ে, পরমাণুর আকার ততই হ্রাস পায়।
কারণ একই পর্যায়ে পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে একটি করে ইলেকট্রন যুক্ত হয়, কিন্তু ইলেকট্রনের স্তর সংখ্যা বাড়ে না। তাই পারমাণবিক সংখ্যা বৃদ্ধি মানেই নিউক্লিয়াসের ধনাত্মক আধানের বৃদ্ধি পাওয়াকে বোঝায় ।
মৌলের ইলেকট্রনিক কক্ষে ইলেকট্রনের সংখ্যা নির্ণয়ের সূত্রঃ
কোন শক্তিস্তরে সর্বোচ্চ সংখ্যক ইলেকট্রন থাকতে পারে। (n = শক্তিস্তর)
১ম শক্তিস্তরে সর্বোচ্চ ইলেকট্রন সংখ্যা =
২য় শক্তিস্তরে সর্বোচ্চ ইলেকট্রন সংখ্যা =
৩য় শক্তিস্তরে সর্বোচ্চ ইলেকট্রন সংখ্যা =
চতুর্থ শক্তিস্তরে সর্বোচ্চ ইলেকট্রন সংখ্যা =
পারমাণবিক সংখ্যা ও ভর সংখ্যা
পারমাণবিক সংখ্যা : নিউক্লিয়াসে অবস্থিত পরমাণুর প্রোটন সংখ্যাকে পারমাণবিক সংখ্যা বা নিউক্লিয়ন সংখ্যা বলে। একে Z দ্বারা প্রকাশ করা হয়। এটি যে কোন মৌলের মৌলিক ধর্ম। একটি পরমাণুতে যতটি প্রোটন থাকে ততটি ইলেকট্রন থাকে। পারমাণবিক সংখ্যার আবিষ্কারক হল মোসলে। ইউরেনিয়ামের পারমাণবিক সংখ্যা ৯২, আর্সেনিকের পারমাণবিক সংখ্যা ৩৩, সিলিকনের পারমাণবিক সংখ্যা ১৪। কার্বনের পারমাণবিক সংখ্যা ৬ বলতে বুঝায় - কার্বনের পরমাণুতে ৬টি প্রোটন রয়েছে।
নিউক্লিয়ন সংখ্যা বা পারমাণবিক ভর সংখ্যা (Mass Number): : নিউক্লিয়াসে অবস্থিত প্রোটন ও নিউট্রনের মোট সংখ্যাকে ভর সংখ্যা বলে। ক্লোরিনের ভর সংখ্যা ৩৫ বলতে বুঝায় ক্লোরিন পরমাণুর নিউক্লিয়াসে অবস্থিত নিউট্রন ও প্রোটনের সংখ্যার সমষ্টি ৩৫। ক্লোরিনে ১৭টি প্রোটন ও ১৮টি নিউট্রন রয়েছে। সোডিয়ামের ভর সংখ্যা ২৩। এতে ১১টি প্রোটন ও ১২টি নিউট্রন রয়েছে। ভর সংখ্যাকে A দ্বারা প্রকাশ করা হয় । প্রোটন সংখ্যা P, নিউট্রন সংখ্যা N হলে, নিউক্লিয়ন সংখ্যা A = P + N.
পারমাণবিক ভর : পারমাণবিক ভর একটি সরল রাশি যা কোন পরমাণু একটি কার্বন-১২ পরমাণুর ভরের অংশের তুলনায় কতগুণ ভারী তা প্রকাশ করে। এ ধারণা প্রদান করেন জন ডাল্টন। পারমাণবিক ভরের কোন একক নেই।
আণবিক ভর : কোন অণুতে বিদ্যমান মৌলগুলোর পারমাণবিক ভরকে মৌলগুলোর পারমাণবিক সংখ্যা দ্বারা গুণ করে গুণফলসমূহ যোগ পাওয়া যায়। অক্সিজেনের আণবিক ভর ৩২।
পানির আণবিক ভর: পানির সংকেত H2O । পানির একটি অণুতে ২টি হাইড্রোজেন ও ১টি অক্সিজেন পরমাণু বিদ্যমান ।
পানির আণবিক ভর = (হাইড্রোজেনের পারমাণবিক ভর×২)+(অক্সিজেনের পারমাণবিক ভর×১) = (১×২) + (১৬×১) = ২ + ১৬ = ১৮
| মৌল | পারমাণবিক সংখ্যা | ভর সংখ্যা |
|---|---|---|
| হাইড্রোজেন | ১ | ১ |
| হিলিয়াম | ২ | ৪ |
| লিথিয়াম | ৩ | ৭ |
| কার্বন | ৬ | ১২ |
| নাইট্রোজেন | ৭ | ১৪ |
| অক্সিজেন | ৮ | ১৬ |
| ফ্লোরিন | ৯ | ১৯ |
| নিয়ন | ১০ | ২০ |
| সোডিয়াম | ১১ | ২৩ |
| ম্যাগনেসিয়াম | ১২ | ২৪ |
| অ্যালুমিনিয়াম | ১৩ | ২৭ |
| সিলিকন | ১৪ | ২৮ |
| ফসফরাস | ১৫ | ৩১ |
| সালফার | ১৬ | ৩২ |
| ক্লোরিন | ১৭ | ৩৫ |
| পটাশিয়াম | ১৯ | ৩৯ |
| ক্যালশিয়াম | ২০ | ৪০ |
| আয়রণ | ২৬ | ৫৬ |
| জিঙ্ক | ৩০ | ৬৫ |
| আর্সেনিক | ৩৩ | ৭৫ |
| প্লাটিনাম | ৭৮ | ১৯৫ |
| পারদ | ৮০ | |
| লেড | ৮২ | ২০৭ |
| ইউরেনিয়াম | ৯২ | ২৩৮ |
বিভিন্ন বিজ্ঞানী এ যাবৎ আপেক্ষিক পারমাণবিক ভর প্রকাশের জন্য তিনটি স্কেল ব্যবহার করেছেন: ১. হাইড্রোজেন স্কেল ২. অক্সিজেন স্কেল ও ৩. কার্বন স্কেল । ১৯৬১ সাল থেকে বিজ্ঞানীরা সবক্ষেত্রে কার্বন স্কেল ব্যবহার করছেন।
পারমাণবিক ওজন: পরমাণুর ওজন খুবই সামান্য । এতো সামান্য যে, সাধারণ প্রচলিত এককের হিসাবে একে ওজনহীন বলা চলে। তাই পরমাণুর ওজন বলতে বোঝায় ঐ মৌলের একটি পরমাণুর ওজনের সাথে
একটি হাইড্রোজেন পরমাণুর ওজনের অনুপাত। মৌলের পারমাণবিক ওজন একটি সংখ্যামাত্র।
যেমন- অক্সিজেনের পারমাণবিক ওজন ১৬ বলতে বোঝায়, একটি অক্সিজেন পরমাণুর ওজন ও একটি হাইড্রোজেন পরমাণুর ওজনের অনুপাত ১৬ ।
পারমাণবিক ভর বা ওজন ধারণার প্রবর্তক: জন ডাল্টন।
আধুনিক রসায়নের প্রতিষ্ঠাতা: জন ডাল্টন।
বিজ্ঞানীরা অণু বা পরমাণু সমূহের তুলনামূলক বা আপেক্ষিক ভর ব্যবহার করেন। কারন অণু বা পরমাণুসমূহের ভর এত ক্ষুদ্র যে তা মনে রাখা এবং হিসেবে ব্যবহার করা অসুবিধাজনক ।
আণবিক ওজন (Molecular weight) :
কোন বস্তুর আণবিক ওজন হলো একটি সংখ্যা মাত্র । বস্তুর একটি অণু হাইড্রোজেনের একটি পরমাণুর তুলনায় কতগুণ ভারী, সেই তুলনামূলক সংখ্যাটিই হবে উক্ত বস্তুর আণবিক ওজন। যেমন : অক্সিজেনের আণবিক ওজন ৩২ । অর্থাৎ অক্সিজেনের একটি অণুর ওজন হবে হাইড্রোজেনের ৩২টি অণুর ওজনের সমান। যে কোন বস্তুর আণবিক ওজন পাওয়া যায় উক্ত বস্তুর আণবিক সংকেত ও তার অন্তর্গত মৌলসমূহের ওজনের সংখ্যা থেকে । যেমন, পানির আণবিক সংকেত হলো- H-O- H । অর্থাৎ পানির অণুতে একটি অক্সিজেন পরমাণু ও দুটি হাইড্রোজেন পরমাণু আছে।
হাইড্রোজেনের পরমাণুর ওজন = ১.০০৮ বা ১.০
অক্সিজেনের পরমাণুর ওজন = ১৬
সুতরাং পানির আণবিক ওজন হবে = H-O-H =১১.০ + ১৬ + ১১.০ = ১৮
সালফিউরিক এসিড-এর molecular weight ৯৮
পানিতে হাইড্রোজেন ও অক্সিজেনের আয়তনের অনুপাতঃ ২ : ১।
হাইড্রোজেন ও অক্সিজেনের ভরের অনুপাত = (১×২) : ১৬ = ২ : ১৬ = ১ : ৮
‘এক মোল পরমাণু’ বলতে বুঝায়: যে কোন মৌলের পারমাণবিক ভরকে গ্রামে প্রকাশ করলে যে পরিমাণ পাওয়া যায়, সে পরিমাণ মৌলকে উক্ত মৌলের এক মোল পরমাণু বলা হয় ।
১ মোল পরমাণু হাইড্রোজেন = ১ গ্রাম হাইড্রোজেন । ( ∴ হাইড্রোজেনের পারমাণবিক ভর ১)
১ মোল পরমাণু অক্সিজেন = ১৬ গ্রাম অক্সিজেন । ( ∴ অক্সিজেনের পারমাণবিক ভর ১৬)
‘এক মোল অণু” বলতে বুঝায়: কোন বস্তুর আণবিক ভরকে গ্রামে প্রকাশ করলে যে পরিমাণ পাওয়া যায়, সে পরিমাণ বস্তুকে গ্রাম আণবিক ভর বা এক মোল অণু বলা হয় ।
১ মোল অণু অক্সিজেন = ৩২ গ্রাম অক্সিজেন । ( ∴ অক্সিজেনের আণবিক ভর ৩২)
১ মোল অণু পানি = ১৮ গ্রাম পানি । ( ∴ পানির আণবিক ভর ১৮)
অ্যাভোগেড্রো সংখ্যা: যে কোন বস্তুর এক মোল একটি নির্দিষ্ট সংখ্যক কণা থাকে। এ সংখ্যাকে অ্যাভোগেড্রো সংখ্যা বলে ।
অ্যাভোগেড্রো সংখ্যার মান: ।
এক মোল পানিতে পানির অণু আছে: ৬.০২×১০ টি ।
এক মোল পরমাণু অক্সিজেনে অক্সিজেনের পরমাণু আছে: টি।
প্রমাণ তাপমাত্রা ও চাপে সকল গ্যাসেরই মোলার আয়তন: ২২.৪ লিটার।
কোন গ্যাসের আণবিক ভর তার বাষ্প ঘনত্বের দ্বিগুণ ।
আইসোটোপ, আইসোটোন, আইসোবার, আইসোমার
আইসোটোপ: যে সব পরমাণুর প্রোটন সংখ্যা সমান কিন্তু ভর সংখ্যা ভিন্ন হয়, তাদেরকে পরস্পরের আইসোটোপ বলা হয়। হাইড্রোজেনের তিনটি আইসোটোপ যথা : প্রোটিয়াম , ডিউটেরিয়াম এবং ট্রিটিয়াম -এ নিউট্রন সংখ্যা যথাক্রমে ০, ১ ও ২ । নিউট্রন সংখ্যার তারতমোর কারণে আইসোটোপ তৈরি হয়।
এটমিক সংখ্যা একই হওয়া সত্ত্বেও নিউক্লিয়াসের নিউট্রন সংখ্যা বেশি হওয়ার ফলে ভরসংখ্যা বেড়ে যায় বলে তাদেরকে আইসোটোপ বলে ।
আইসোটোপের বৈশিষ্ট্য: [ক] আইসোটোপগুলো একই মৌলের পরমাণু । [খ] ভৌত ধর্মের সামান্য পার্থক্য থাকলেও রাসায়নিক ধর্ম একই।
আইসোটোন: যে সকল পরমাণুর নিউট্রন সংখ্যা সমান কিন্তু প্রোটন সংখ্যা ও ভর সংখ্যা ভিন্ন, তাদেরকে পরস্পরের আইসোটোন বলে ।
আইসোবার: যে সকল পরমাণুর ভর সংখ্যা সমান কিন্তু প্রোটন সংখ্যা ভিন্ন, তাদেরকে পরস্পরের আইসোবার বলে । হাইড্রোজেনের তিনটি আইসোটোপ প্রোটিয়াম , ডিউটেরিয়াম ও ট্রিটিয়াম । প্রোটিয়াম, ডিউটেরিয়াম এবং ট্রিটিয়ামের ভর সংখ্যা যথাক্রমে ১, ২ এবং ৩ । তিনটি আইসোটোপেরই পারমাণবিক সংখ্যা ১। সুতরাং প্রোটিয়াম, ডিউটেরিয়াম এবং ট্রিটিয়ামের নিউট্রন সংখ্যা যথাক্রমে ০, ১ এবং ২ ।
ভারী পানি: ডিউটেরিয়াম অক্সাইড, সংকেত ।
ইউরেনিয়ামের আইসোটোপ:
ইউরেনিয়ামের বহুল ব্যবহৃত আইসোটোপ: (পারমানবিক চুল্লীতে ব্যবহৃত হয়)।
আইসোমার: যে সকল পরমাণুর পারমাণবিক সংখ্যা এবং ভর সংখ্যা একই কিন্তু তাদের অভ্যন্তরীণ গঠন ভিন্ন, তাদেরকে পরস্পরের আইসোমার বলে। যেমনঃ অ্যামোনিয়াম সায়ানেট ও ইউরিয়া পরস্পরের আইসোমার ।
-এর আইসোমারের সংখ্যা: ৩টি। (পেন্টেন, ২-মিথাইল বিউটেন, ২,২ ডাই মিথাইল প্রোপেন)
